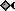В пластовых водах углекислый газ находится как в свободной, так и растворенной формах. Он может присутствовать в виде недиссоциированных молекул угольной кислоты H2CO3, гидрокарбонат — ионов HCO3- и карбонатных ионы CO32-.
|
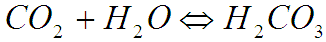 , ,
|
Далее слабая углекислота ступенчато диссоциирует с образованием гидрокарбонат и карбонат ионов:
|
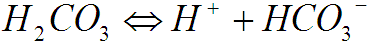 , ,
|
|
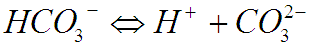 , ,
|
Из выше приведенных уравнений следует, что степень диссоциации H2CO3 зависит от концентрации ионов водорода, т.е. от значения рН. Таким образом, при различных показателях рН в растворе будут доминировать определенные солеобразующие ионы.
В кислых и слабокислых водах (рН=1-3 и рН=4-6), доминирует недиссоциированная кислота; в нейтральных и слабощелочных водах (рН=6-8 и рН=8-10) — ион HCO3, в сильно щелочных водах (рН=11-14) — ион CO32-.
В пластовых условиях при постоянном давлении и температуре различные формы углекислоты в водных растворах находятся в динамическом равновесии между собой:
|
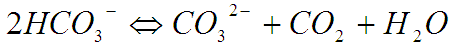 , ,
|
Как следует из выше приведенного уравнения, карбонатное равновесие определяется количеством свободного CO2.
При наличии в пластовых водах одновременно ионов Ca2+, Mg2+ и HCO3- образуются непрочные растворимые бикарбонаты кальция и магния равновесное содержание которых, также поддерживается за счет свободного углекислого газа:
В природных пресных водах бикарбонат кальция находится в динамическом равновесии с карбонатом кальция и диоксидом углерода:
|
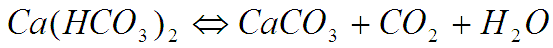 , ,
|
Таким образом, далее можно записать:
Откуда следует, что любое воздействие, в результате которого CO2 удаляется из системы (например, при повышении температуры или увеличении щелочности системы), приводит к сдвигу химического равновесия реакции приведенной выше вправо и выпадению осадка карбоната кальция.
При движении нефти, газа и пластовой воды по стволу скважины, выкидным линиям и сборным коллекторам, давление в них понижается и растворимость CO2 в воде уменьшается, в результате чего из нее выделяется диоксид углерода, при этом нарушается карбонатное равновесие. Для восстановления равновесия избыток гидрокарбонат — ионов HCO3- удаляется из системы путем превращения гидрокарбонатов кальция и магния в карбонаты, которые выпадают в осадок и отлагаются на стенках труб, снижая их пропускную способность.
На основании выше изложенного можно выделить следующие причины образования карбонатных солей:
- снижение давления при подъеме скважинной продукции;
- повышение температуры, например, за счет теплоотдачи погружного электродвигателя;
- пересыщение раствора растворимой солью по причине изменения давления и температуры или смешения вод одного типа, но с разной концентрацией ионов; например, при закачке воды, содержащей гидрокарбонат кальция, в пласты с высокой температурой равновесие реакции сдвигается вправо и в результате реакции образуется малорастворимый карбонат кальция:
- изменение химического состава воды при смешении вод различных типов:
| 
 copyright aznunion © 2009-2026
copyright aznunion © 2009-2026